
نگاهی به پروژه میکروبیوم انسانی: داروهایی که از محتویات روده تولید می شوند
مدتهاست که کمپانی «سِرِس تراپیوتیکس» (Seres Therapeutics) در حوزه محتویات روده انسان برای خودش نامی دست و پا کرده و به پیشگام این عرصه تبدیل شده. مقر این شرکت بیوفناوری در شهر کمبریج در ایالات ماساچوست ...
مدتهاست که کمپانی «سِرِس تراپیوتیکس» (Seres Therapeutics) در حوزه محتویات روده انسان برای خودش نامی دست و پا کرده و به پیشگام این عرصه تبدیل شده. مقر این شرکت بیوفناوری در شهر کمبریج در ایالات ماساچوست آمریکا و در ساختمانی قرار دارد که میزبان یکی از برجسته ترین نام های صنعت ژنتیک پزشکی یعنی «کریسپر تراپیوتیکس» (Crispr Therapeutics) نیز هست.

کمپانی بیوفناوری مورد بحث تلاش می کند تا با جمع آوری و استفاده از میلیاردها گونه باکتریایی موجود در روده انسان به تولید دارو بپردازد. این باکتری ها در کنار دیگر گونه ها که روی بدن ما یا داخل آن زندگی می کنند، مجموعه «میکروبیوم انسانی» را تشکیل می دهند.
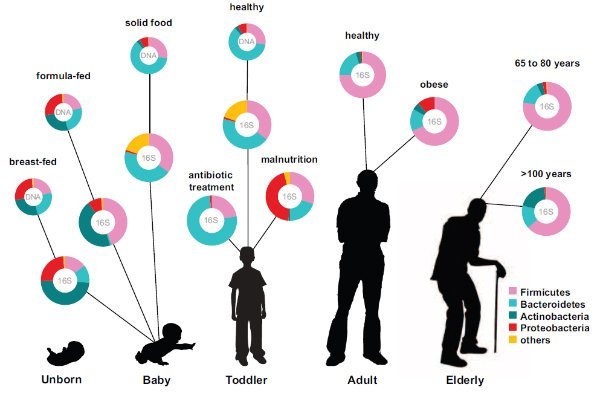
میکروبیوم انسانی، جهانی پنهان از دید طبیعی ماست که اخیراً مورد توجه قرار گرفته. دانشمندان به تازگی دریافته اند عدم توازن در میکروارگانیسم های سیستم گوارشی می تواند بیماری ها و امراض متعددی را ایجاد نماید. سیستم گوارش انسان اکوسیستمی پیچیده و دقیق است که بر اثر مواردی همچون افزایش سن و سال، مسافرت، یا حتی استفاده از داروهای جدید به مخاطره می افتد.
سِرِس یکی از نخستین استارتاپ هایی محسوب می شود که قصد دارد با ارائه روش های درمانی مبتنی بر تغییر این میکروبیوم، به اصلاح اکوسیستم گوارشی و مقابله با بیماری ها بپردازد. این شرکت سال گذشته سهام خود را به صورت عمومی عرضه کرد و به مبلغ 133.7 میلیون دلار ارزش گذاری شد.
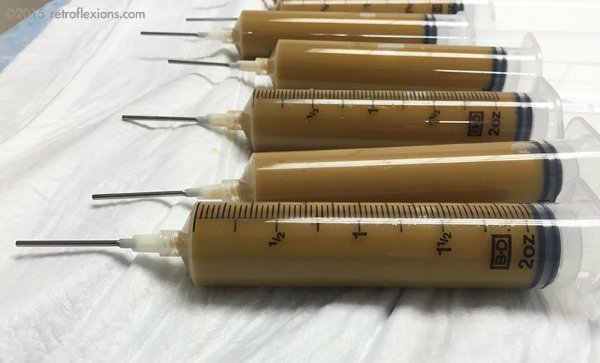
اقبال سهام عمومی سِرِس، روند توسعه نخستین داروی آنها را سرعت بخشید: مجموعه ای از میکروب ها که از مدفوع انسان به دست آمده، با اتانول شسته و پاکسازی شده، و نهایتاً به صورت فشرده در قالب قرص عرضه می گردند.
متخصصین از اصطلاح «پیوند میکروبیوم مدفوع» (fecal microbiota transplant) یا FMT برای عملیات انتقال محتویات روده از یک شخص به دیگری استفاده می کنند، و انتظار می رفت درمان خوراکی سِرِس در این زمینه تأثیری معجزه آسا داشته باشد.
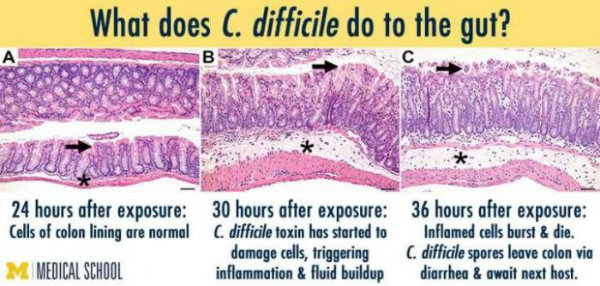
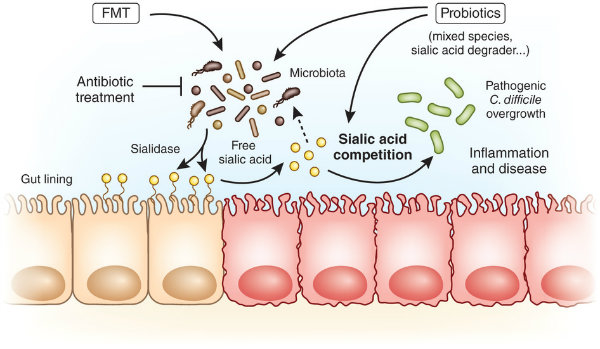
یکی از کشنده ترین عفونت های روده انسان که توسط باکتری «کلوستریدیوم دیفیسیل» (Clostridium difficile) به وجود می آید، «انتروکولیت با غشای کاذب» نام دارد که درمان آنتی بیوتیک نیز روی آن نتیجه بخش نیست. این عارضه در افرادی ایجاد می شود که به خاطر استفاده شدید از آنتی بیوتیک، بخش اعظم باکتری های سیستم گوارش خود را از دست داده اند.
آزمایشات اولیه نشان دادند روش درمانی سِرِس، عفونت C. Diff را در 97 درصد موارد از بین می برد، نتیجه ای که کمپانی های داروسازی حتی در خواب هم نمی دیدند. این استارتاپ درخواست تأییدیه این روش درمانی را به سازمان غذا و داروی آمریکا (FDA) ارسال کرد و بنابراین نخستین شرکت فعال در زمینه درمان هدفمند اختلالات گوارشی محسوب می شود، از C. diff گرفته تا بیماری کرون (Crohn's Disease).
چند هفته بعد، این کمپانی نتایج آزمایشات مرحله دوم خود را اعلام کرد: عفونت تقریباً نیمی از بیماران به C. diff دوباره عود کرده بود، یعنی به لحاظ آماری روش درمانی سِرِس تفاوت چندانی با حالت عادی نداشت. شاید بتوان گفت نخستین قرص مدفوع با شکست مواجه شده است.
در فاصله ای کوتاه از مقر اصلی سِرِس، بزرگ ترین بانک مدفوع جهان به نام OpenBiome قرار گرفته. دانشمندان این مرکز نیز تلاش دارند تا عفونت C. diff را درمان کنند، با این تفاوت که محصول آنها به مدت چندین سال مورد استفاده قرار گرفته.
OpenBiome به تأثیر قدرتمند مدفوع خالص و فراوری نشده اعتقاد دارد. هر ماه، صدها نفر داوطلب به صورت ناشناس، بسته هایی حاوی مدفوع خود را در اختیار این بانک قرار می دهند، و متخصصین به توزین و درجه بندی هر نمونه بر اساس «مقیاس مدفوع بریستول» (Bristol stool scale) می پردازند.
در مرحله بعد، محلول آب نمک به محتویات بسته افزوده شده و ترکیب حاصل منجمد می گردد، تا برای پزشکان و محققین سرتاسر آمریکا ارسال گردد. از زمان تأسیس OpenBiome در سال 2012، این فرایند ساده و داوطلبانه اهدای مدفوع توانسته بیش از 15 هزار مورد ابتلا به C. diff را درمان نماید.
نحوه تحویل دارو به بدن بیمار به هیچ وجه اهمیت ندارد؛ تنقیه، کولونوسکوپی، کپسول خوراکی حاوی مدفوع فشرده و منجمد، همگی در درمان بیماری فوق موفق هستند؛ اما مصرف مجدد محتویات روده به یکی از چالش های نهادهای رگولاتوری تبدیل شده است.
بنا به نظر متخصصین FDA و البته عقل سلیم، روش OpenBiome تنها راهکاری کوتاه مدت خواهد بود، تا زمانی که روش بهتری ابداع گردد. اگرچه اهداکننگان مدفوع از نظر بیماری های خطرناک مورد ارزیابی و غربالگری قرار می گیرند، اما هیچ آزمایشی نمی تواند همه چیز را تضمین کند.
همچنین فقط احتمال وجود باکتری هایی نظیر E. coli در نمونه های اهدایی، سلامت بیماران را به خطر نمی اندازد، بلکه ساختار باکتریایی بیگانه به تنهایی می تواند دردسر آفرین باشد، چون میکروارگانیسم های سیستم گوارش دو فرد می توانند تا 90 درصد با یکدیگر تفاوت داشته باشند.
به همین دلیل در سال 2013 سازمان غذا و داروی آمریکا پیوندهای مدفوع را در دسته دارویی قرار داد و آینده OpenBiome را در هاله ای از ابهام فرو برد. اگرچه بانک مدفوع هنوز هم به فعالیت خود ادامه می دهد، اما توسعه روش های ایمن تر به نابودی آنها منجر خواهد شد.
در همین گیر و دار، سرِس فرصتی یافت تا OpenBiome را شکست دهد، چون ظاهراً توانسته بود مجموعه میکروب های سیستم گوارشی که به مقابله با C. diff می پردازند را شناسایی کند. بنابراین برخلاف OpenBiome که مدفوع کامل را تحویل می دهد و مطمئن است بخشی از آن به کمک بیمار خواهند آمد، سِرِس از راهکاری مطمئن تر و سازگارتر با قواعد رگولاتوری استفاده می نماید.
طبق اطلاعات محدودی که از سِرِس به دست آمده، حیات باکتری های C. diff به برخی اسیدهای صفراوی خاص در روده وابسته است که هرچه تغذیه بیشتری داشته باشند، عفونت روده نیز وخیم تر خواهد شد. از طرفی، باکتری های سودمند دیگری نیز در روده حضور دارند که از همین اسیدها تغذیه می کنند. بنابراین افزودن جمعیت زیادی از باکتری های مفید می تواند رقابت در روده را به نفع آنها و به ضرر C. diff تغییر دهد.
سِرِس با دریافت مدفوع از اهداکنندگان سالم و کاهش تعداد کل میکروارگانیسم ها به حدود 50 گونه خاص هاگ زا، و نهایتاً افزودن اتانول برای از بین بردن هرگونه پاتوژن دیگر، قرص مدفوعی را تولید کرد که حتی FDA هم از آن رضایت داشت.
«دیل گردینگ» اپیدمیولوژیستی که از سال 1980 میلادی روی C. diff تحقیق کرده، می گوید در ابتدا همه نسبت به عملکرد تأثیرگذار باکتری های هاگ زا بسیار شگفت زده بودند، اما پس از اینکه آزمایشات ثانویه سِرِس نتیجه ناامیدکننده ای را حاصل کرد، طرح فوق به کلی زیر سؤال رفت.
در واقع به عقیده گردینگ، سِرِس با کشف خود تمام حوزه درمانی مبتنی بر میکروبیوم را متحول ساخت. پزشکان به توان خارق العاده مدفوع پی بردند، اما تصور کردند می توانند آن را به طور کامل تحت کنترل بگیرند. آنها مطمئنند تئوری سِرِس نتیجه خواهد داد، فقط در حال حاضر باکتری های اشتباهی را برای تولید محصول انتخاب کرده اند.
«کالین کلی» یکی از نخستین متخصصین گوارش بود که در سال 2008 روش پیوند میکروبیوم مدفوع را در ایالات متحده به کار گرفت. او در جریان تحقیقاتش به عوارض جانبی عجیبی برخورد. به عنوان مثال یکی از بیمارانش که به C. diff مبتلا بود، از بیماری آلوپسی عمومی نیز رنج می برد.
این بیمار از 16 سالگی هیچ مویی در بدن نداشت و حتی ابروهایش را نیز از دست داده بود، اما زمانی که به خاطر بیماری گوارشی با استفاده از مدفوع خواهرش تحت درمان قرار گرفت، رشد موهای بدنش نیز از سر گرفته شد.
زمانی که «کلی» نتایج را با همکارش در میان گذاشت، متوجه شد که یکی دیگر از بیماران با سابقه مشابه نیز رشد مجدد مو را تجربه کرده است. دو پزشک کاملاً مبهوت شدند، اما به منابع کافی برای تجزیه و تحلیل میکروبیوم دو بیمار دسترسی نداشتند.
با این حال، پس از آن نمونه های متعددی از این وضعیت مشاهده شد و متخصصین دریافتند اثرات درمانی میکروبیوم گوارشی انسان به بیماری های روده محدود نمی شود. برخی بیماران پس از درمان با تغییرات چشمگیر وزن مواجه شدند، و افسردگی بعضی دیگر نیز درمان شد، اما دلیل این نتایج هنوز هم ناشناخته مانده است.
به همین دلیل چند ماه قبل مؤسسه ملی سلامت آمریکا برای نخستین بار بودجه ای را به مرکز ثبت پیوند مدفوع اختصاص داد. در این مرکز، وضعیت میکروبیوم گوارشی هزاران بیمار، قبل و بعد از انجام پیوند مدفوع در سیستم ثبت می گردد تا متخصصین درک بهتری از تغییرات ناشی از عملیات فوق پیدا کنند و علاوه بر شناخت میکروارگانسیم های مقابله کننده با C. diff، دلیل بروز عوارض جانبی را نیز بشناسند.
اگر «کلی» به چنین مرکزی دسترسی داشت، می توانست نوعی درمان میکروبیوم اختصاصی و هدفمند را ابداع کند که رشد مجدد مو در بیماران مبتلا به آلوپسی را میسر می ساخت.
کمی دورتر از مقر سِرِس، استارتاپ دیگری در حوزه میکروبیوم به نام «ودانتا بایوساینسز» (Vedanta Biosciences) قرار دارد. شاید بتوان گفت این بخش از ماساچوست بیشترین حجم مدفوع انسانی در کل آمریکا را در اختیار دارد. شرکت ودانتا تا به امروز نتایج ضد و نقیضی ارائه کرده و اگرچه هنوز با مدفوع کامل سر و کار دارد، اما به دنبال روش های سالم تری برای عرضه محصول می گردد.
در آزمایشگاه های مجهز وادنتا، ربات های مخصوص به ارزیابی نمونه محتویات روده از سرتاسر جهان مشغولند تا گونه های خاص باکتری را شناسایی کرده و آنها را تکثیر نمایند. سپس الگوریتم های ویژه به دنبال ارتباط بین بیماری ها و باکتری های خاص می گردند تا نهایتاً مشخص شود از کدام گونه میکروارگانیسم می توان برای درمان چه بیماری هایی استفاده کرد.
در واقع مرکز تحقیقاتی پیشرفته وادنتا با استفاده از ربات ها برای پرورش میکروب ها و باکتری های مفید بر اساس اطلاعات موجود و بدون نیاز به مدفوع بیشتر یا دخالت انسان، می تواند تمام مزایای این روش درمانی را در قالبی ایمن و استریل ارائه نماید.
تحقیقاتی از این دست، می تواند درمان های مبتنی بر میکروبیوم را متحول سازد، و شرکت های متعددی با اتخاذ این رویکرد، تجزیه و تحلیل دقیق نتایج آزمایشات سِرِس، پیگیری وضعیت بیماران OpenBiome و دسترسی به پایگاه داده رو به رشد مؤسسه ملی سلامت، می توانند به محصولات و داروهایی هدفمند در این حوزه دست یابند.
دیدگاهها و نظرات خود را بنویسید
برای گفتگو با کاربران ثبت نام کنید یا وارد حساب کاربری خود شوید.

















باید باید بهتون جایزه داد که رسما مدفوع خوری رو شروع میکنید.
موفق باشید
با خوردن مدفوع،روزگار خوبی داشته باشید
چقدر بده که به جای سرمایه گذاری روی پروژه های مفیدی مثل این پروژه که میتونه زندگی میلیون ها بیمار رو بهتر کنه، اکثر انرژی و بودجه سیلیکون ولی صرف این میشه که صفحه فلان گوشه 1 درصد بزرگتر بشه
میلیارد ها گونه باکتریایی روده!wtf